近期,我校3044am永利集团3044noc郑璞教授团队在组合计算策略提高D-泛解酸内酯水解酶催化效率方面取得重要进展,并发表研究成果“Enhancing the Catalytic Efficiency of D-lactonohydrolase through the Synergy of Tunnel Engineering, EvolutionaryAnalysis, and Force-Field Calculations”, (Hot Paper).(https://doi.org/10.1002/chem.202304164)

研究背景
D-泛解酸内酯水解酶(D-Lac)用于DL-泛解酸内酯(DL-PL)的经典动力学拆分,生成D-泛解酸内酯(D-PL),D-PL是生产D-泛酸(维生素B5)的关键中间体。维生素B5广泛应用于食品、制药、动物饲料和化妆品行业。在体内,维生素B5对乙酰辅酶A的生物合成至关重要,而乙酰辅酶A是脂肪酸代谢和神经递质乙酰胆碱的生物合成所必需的。此前,研究者尝试了易错PCR和DNA重组等技术,并没有达到预期的结果。因此,D-Lac的进化是一项具有挑战性的工作,这是由于缺乏D-Lac的晶体结构和对其催化机理的了解有限,无法进行合理的设计。此外,底物(D-PL)缺乏大的或极性基团,活性位点结合袋中的单个氨基酸改变导致活性位点与底物整体形状之间的互补性较低。
针对以上问题,该团队采用组合策略,整合了底物通道工程、进化分析和力场计算,以提高D-泛解酸内酯水解酶(D-Lac)的活力,最终获得了最佳突变体N96S/A271E/F274Y/F308G(M3),其催化效率(kcat/KM)比野生型高23倍,使用突变体M3全细胞可将浓度为20%的DL-泛解酸内酯转化为D-泛酸(D-PA,>99% e.e.),转化率达47%,时空产量为107.1 g L−1h−1,表明其在工业大规模生产D-泛酸的巨大潜力。分子动力学(MD)模拟显示,突变体M3的活力提升是在底物通道内部消除了空间位阻,并通过远端Loop的构象重塑使“催化”构象更有利,使得底物和酶更易进入它们的预反应状态。本研究阐明了D-Lac底物通道入口处关键Loop上远端残基的潜在作用,使其成为能够重塑能量格局并因此影响酶活性的新型修饰热点。
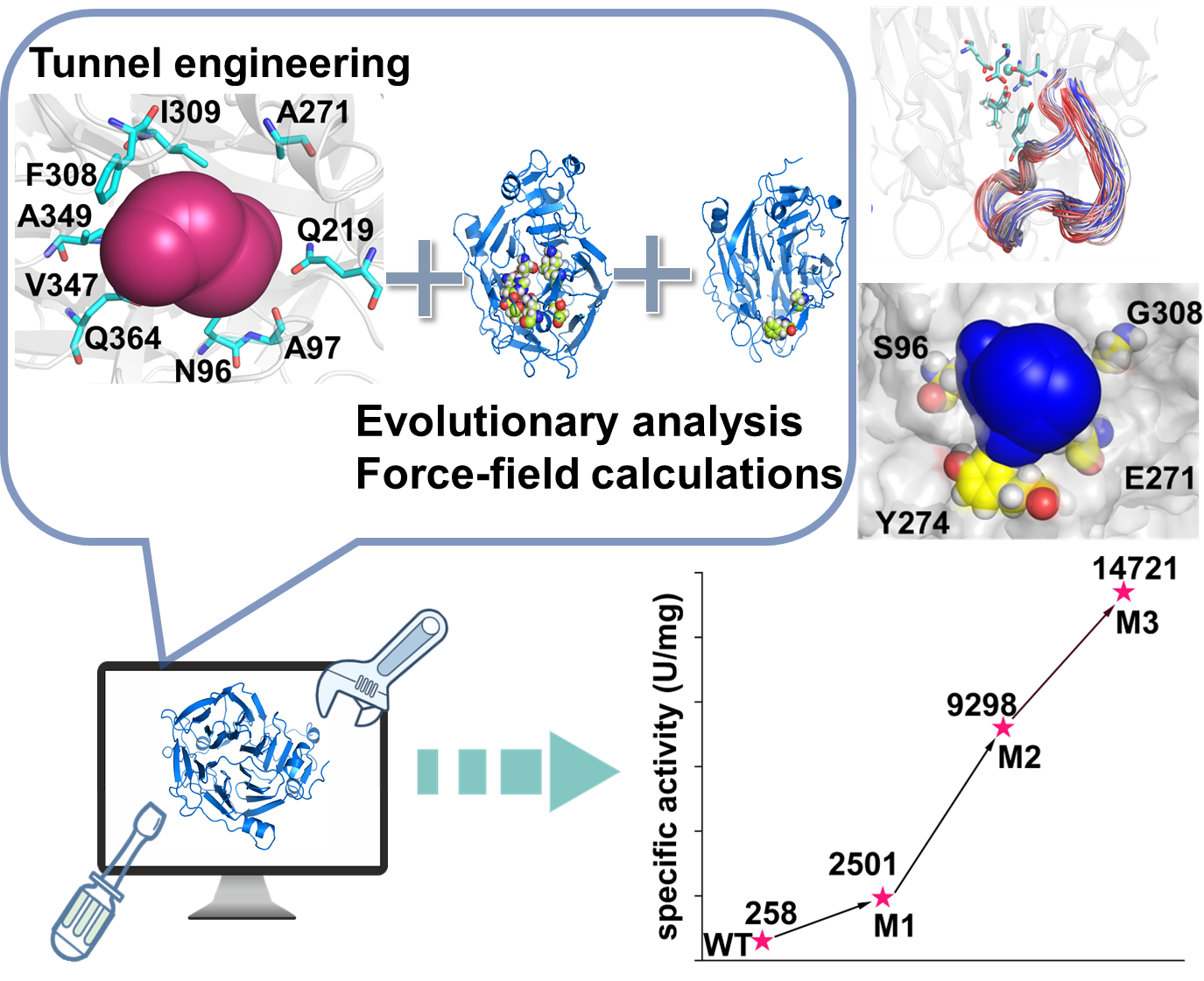
图形摘要
3044am永利集团3044noc2021级博士生孙若斌为该论文第一作者,郑璞教授为该论文的通讯作者。
近年来,我校3044am永利集团3044noc郑璞教授团队在木质纤维原料的绿色生物加工制造方面取得明显进展,相关成果陆续发表于Journal of Agricultural and Food Chemistry (2023, 71: 19457-19464; 2023, 71: 15213-15223; 2021, 69: 2549-2556)、International Journal of Biological Macromolecules (2024: 130545) 、Bioresource Technology (2021, 323: 124611)、Biotechnology for Biofuels and Bioproducts (2023, 16: 192) 、ACS Sustainable Chemistry & Engineering (2020, 8: 14905-14913)等本领域权威期刊。
