近期,我校3044am永利集团3044noc倪晔教授团队在d-氨甲酰水解酶的工程改造方面取得重要进展,研究成果“Structure-Guided Engineering of D-Carbamoylase Reveals a Key Loop at Substrate Entrance Tunnel”正式发表于ACS Catalysis (IF =/info/1021/ /12.35) (10.1021/acscatal.0c02942)。
光学纯d-氨基酸是合成众多高附加值药物和精细化学品的关键手性中间体,具有重要的意义。传统的化学合成法不仅能耗大,产率低,而且对环境不友好。传统的酶拆分法虽然具有反应条件温和的优势,但是理论产率只有50%。海因酶过程是包含海因消旋酶、d-海因酶和d-氨甲酰水解酶的级联反应,可以完成从底物l-海因到产物d-氨基酸的完全转化,实现100%的理论得率和原子利用率,具有反应条件温和、无中间提取、产物光学纯度高、环境友好的优点,符合原子经济性和绿色化学的发展方向,是制备d-氨基酸的高效方法。然而,在海因酶过程的应用中普遍存在d-氨甲酰水解酶的酶活性低和稳定性差的问题,尤其对于具有较大空间位阻的l-吲哚甲基海因的转化结果不理想,因此获得高催化效率的d-氨甲酰水解酶是至关重要的。
倪晔教授团队针对来自于印度洋硝酸盐还原菌的d-氨甲酰水解酶(NiHyuC)的高Km值导致海因酶过程转化受阻的问题,通过基于晶体结构的半理性设计对NiHyuC进行催化效率改造,并结合晶体结构和分子动力学模拟揭示了d-氨甲酰水解酶催化效率提高的机制,最终将筛选获得的催化剂用于海因酶过程高效制备d-色氨酸。具体实验方案为:首先通过蛋白质结晶获得了NiHyuC野生型的晶体结构,并通过分子对接获得NiHyuC-3a复合物的结构,为了快速获得影响NiHyuC对底物3a亲和力的关键区域,实验分别对NiHyuC及NiHyuC-3a进行分子动力学模拟,通过分析锁定了loop 135-146和loop 200-207关键区域,并通过氨基酸序列保守性分析最终确定了10个非保守突变位点进行饱和突变文库的构建(图一),通过筛选获得了A200E、A200S、A200N、A200H、E138Q、E138W和S207A七个突变体,经过迭代组合突变获得了最优突变体M4(D187N/A200N/S207A/R211G),其kcat/Km为1135.0 min–1·mM–1,为WT的44.2倍,其Km值为0.4 mM,仅为WT的4.5%。之后将M4用于0.5 L放大反应的级联反应,当添加10 kU·L–1AaHyuA、5 kU·L–1AtHyuH 和60 kU·L–1NiHyuC催化160 mM 1a时,12 h的转化率为99.8%,产物得率为99.3%,时空产率为64.9 g·L–1·d–1,该反应的时空产率是Nozaki等人报道的时空产率的5.4倍(12.0 g·L–1·d–1)。为了解释M4催化效率提高的原因,通过蛋白质结晶技术获得了突变体R211G,M3-1和M4的晶体结构,基于晶体结构比对和分子动力学模拟分析发现随着突变位点的增加,位于底物通道入口的loop 200–207区域呈现逐渐向外摆动的趋势,这可能有利于底物通道打开,从而有利于底物进入催化中心参与反应,揭示了loop 200–207可能在调控底物通道中起重要作用(图二)。最后为了从反应机理上揭示突变体M4催化效率提高的机制,实验对WT−3a和M4−3a复合物进行了预反应状态模型统计分析,结果显示(图三)M4−3a更利于形成预反应状态(14.6%),为WT−3a(4.6%)的3.2倍,且具有更好的亲核进攻角度,这表明M4具有更好的反应准备度,解释了催化效率提高的原因。此外,突变体M4具有更小的底物结合口袋,使得其与底物形成了更多的相互作用,同时,通过MM/GBSA方法计算的结合自由能显示M4具有更低的结合自由能,解释了Km值降低的原因。
倪晔教授为该论文的通讯作者,2015级博士生刘亚菲、许国超副教授为该论文的共同第一作者。上述研究工作得到了国家重点研发计划项目(2018YFA0901200)、国家自然科学基金委(22077054,31970041,,21776112)、和轻工业技术与工程国家级一级学科项目(LITE2018-07)的资助。

图一. 基于晶体结构的分子动力学模拟及氨甲酰水解酶的氨基酸序列进化保守性分析
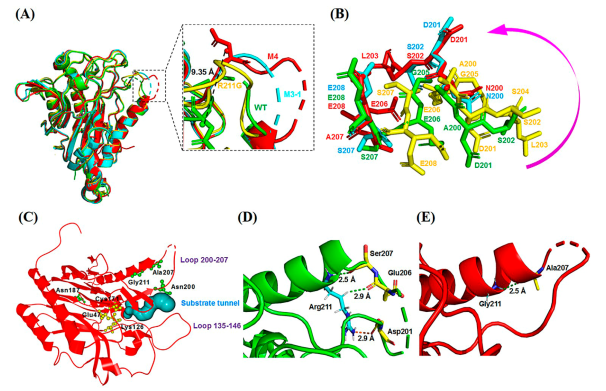
图二. WT与突变体NiHyuC M4的晶体结构比对分析
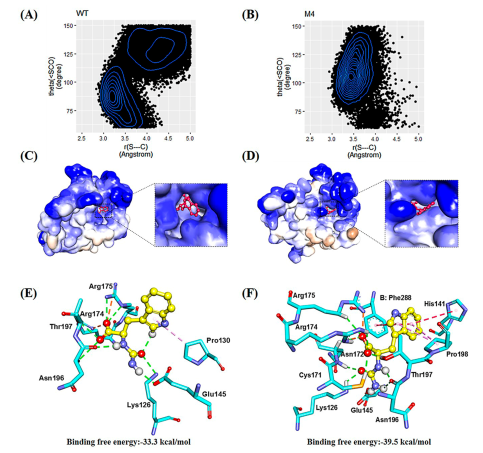
图三 复合物WT−3a及M4−3a预反应状态统计分析及结合自由能分析
