近期,我校3044am永利集团3044noc饶志明教授团队在L-2-氨基丁酸的高效制备方面取得重要进展,研究成果“Efficient single whole-cell biotransformation for L-2-aminobutyric acid production through engineering of leucine dehydrogenase combined with expression regulation”正式发表于Bioresource Technology (IF =/info/1021/ /7.539) (https://doi.org/10.1016/j.biortech.2021.124665)。
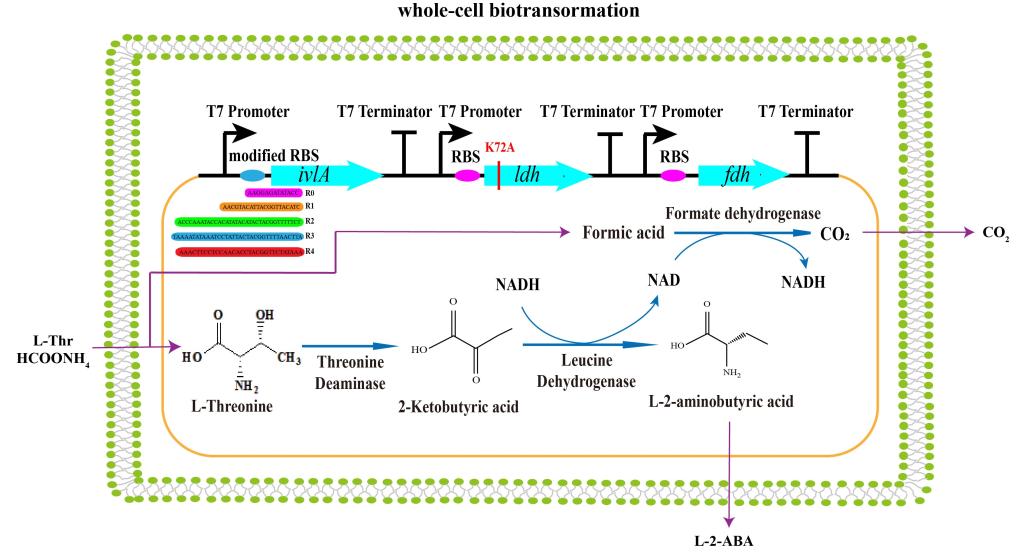
L-2-氨基丁酸(L-2-ABA)是非天然手性氨基酸,广泛用作生产手性药物的前体,以及用于抑制人类神经信息的传递并促进脑细胞的代谢。传统的化学制备方法存在成本高、污染严重、光学纯度低等缺点;常见的生物酶法制备L-2-氨基丁酸为“一锅法”,该方法需要单独发酵培养两种以上菌株、严格控制三种酶(苏氨酸脱氨酶、亮氨酸脱氢酶、甲酸脱氢酶)的添加量,增加了生产成本和工艺要求。因此,需要构建多酶级联催化的单细胞来实现同一宿主的多酶共表达。
饶志明教授团队针对L-2-氨基丁酸制备过程中的限速酶——亮氨酸脱氢酶受2-酮丁酸抑制作用明显、酶活不高的缺点以及多酶体系中催化速率不协调的问题,采用双重策略改造限速步骤高效制备L-2-氨基丁酸。首先,通过设计合理的高通量筛选方法进行定向进化旨在提高亮氨酸脱氢酶的2-酮丁酸耐受性及催化活力,建立将溶菌酶溶解细胞壁获取胞内酶以及紫外分光光度计检测NADH消耗相结合的高通量筛选方法,构建上千样本数的突变文库得到一株酶活提高了45%的突变株X(K72A/M355I/Q361N);构建单点突变株验证了该突变株X的有益突变点为K72A,其比酶活提高到133.3%且半抑制浓度(14.0 g·L-1)也高于野生型(10.5 g·L-1);对K72位点的饱和突变文库进行研究,得到了比酶活分别提高了33.3%、27.8%的K72A、K72W,其中K72A的kcat·Km-1为野生型的2.65倍;GROMACS进行分子动力学模拟,突变后结合口袋的柔性增加,增强了底物和结合口袋处蛋白质残基之间的相互作用。其次,设计不同强度的RBS序列旨在削弱苏氨酸脱氨酶的表达以协调多酶催化速率,获得苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶的多酶级联重组菌E. coli BL21/pET28a-R3ivlA-EsldhK72A-fdh,其产量是未改造菌株的2.6倍。最后,将该菌株用于5 L发酵罐放大,1 L转化体系中投料L-苏氨酸约150 g,L-2-氨基丁酸的产量达121 g,摩尔转化率达95%,时空产率为5.04 g·L-1·h-1。本研究为已报道的多酶协同单细胞制备L-2-氨基丁酸的最高产量,为低成本L-苏氨酸合成高附加值L-2-氨基丁酸提供了一种绿色、高效的合成方法,为有价值的药物中间体的大规模合成提供了可能。
图形摘要
饶志明教授为论文的通讯作者,我校2018级硕士生陈佳杰为第一作者。上述研究得到了国家重点研发计划(2018YFA0900300)、国家自然科学基金(31770058、32070035)等资助。
近年来饶志明教授团队以合成生物学科学理论为指导,在系统开展高效合成高值化合物细胞工厂构建及产业化方面取得丰硕成果,相关研究成果已发表在Science Advances (2020)、Nature Communication (2018)、ACS Catalysis (2018)、Advanced Materials (2018)、Bioresource Technology (2017)、Green Chemistry (2016)、Metabolic Engineering (2016)等本领域权威期刊。
