近期,我校3044am永利集团3044noc倪晔教授团队在生物酶法合成手性药物中间体方面取得重要进展,研究成果“Engineering an Alcohol Dehydrogenase from Kluyveromyces polyspora for Efficient Synthesis of Ibrutinib Intermediate”正式发表于Advanced Synthesis & Catalysis (IF =/info/1021/ /5.851) (https://doi.org/10.1002/adsc.202001313)。
依鲁替尼是全球首个获得美国食品和药物管理局(FDA)批准用于治疗淋巴瘤的BTK抑制剂。2019年,其销售额在全球小分子药物市场排名第三,预测其2024年销售额将达95.57亿美元。(S)-N-Boc-3-羟基哌啶((S)-NBHP)是合成依鲁替尼(ibrutinib)的关键手性中间体,其化学合成路线长且反应条件严苛,因此开发高效的生物催化剂,实现(S)-NBHP的酶法制备受到了研究者的高度关注。
倪晔教授团队通过对来自多孢克鲁维酵母Kluyveromyces polyspora的重组醇脱氢酶KpADH进行改造,获得了不对称催化N-Boc-3-哌啶酮(NBPO)还原生成(S)-NBHP的高效突变酶。首先,基于KpADH的晶体结构和分子对接,构建了底物结合位点的饱和突变文库并进行高通量筛选,发现127位点的突变可实现催化效率和立体选择性的共进化;通过对127位点所有单点突变进行表观动力学参数测定,反应进程和稳定性研究,确定了最优突变体Y127W;在不添加外源辅因子的条件下,引入葡萄糖脱氢酶进行辅酶循环,Y127W可在10小时内实现600 g/L底物的完全转化,计算时空产率为1440 g/(L·d),为目前酶法不对称还原合成(S)-NBHP的最高报道水平;通过对Y127W进行蛋白晶体结构解析和分子动力学模拟,发现突变后127位点色氨酸残基与底物Boc基团形成的额外氢键是其具有优异的催化活力和严格立体选择性的主要原因。该研究不仅为制备手性杂环醇类化合物提供了高效的生物催化剂,而且通过合理的计算机模拟加深了研究者对醇脱氢酶催化活力和立体选择性共进化机制的理解,为蛋白质工程用于新酶的理性设计提供了理论基础。
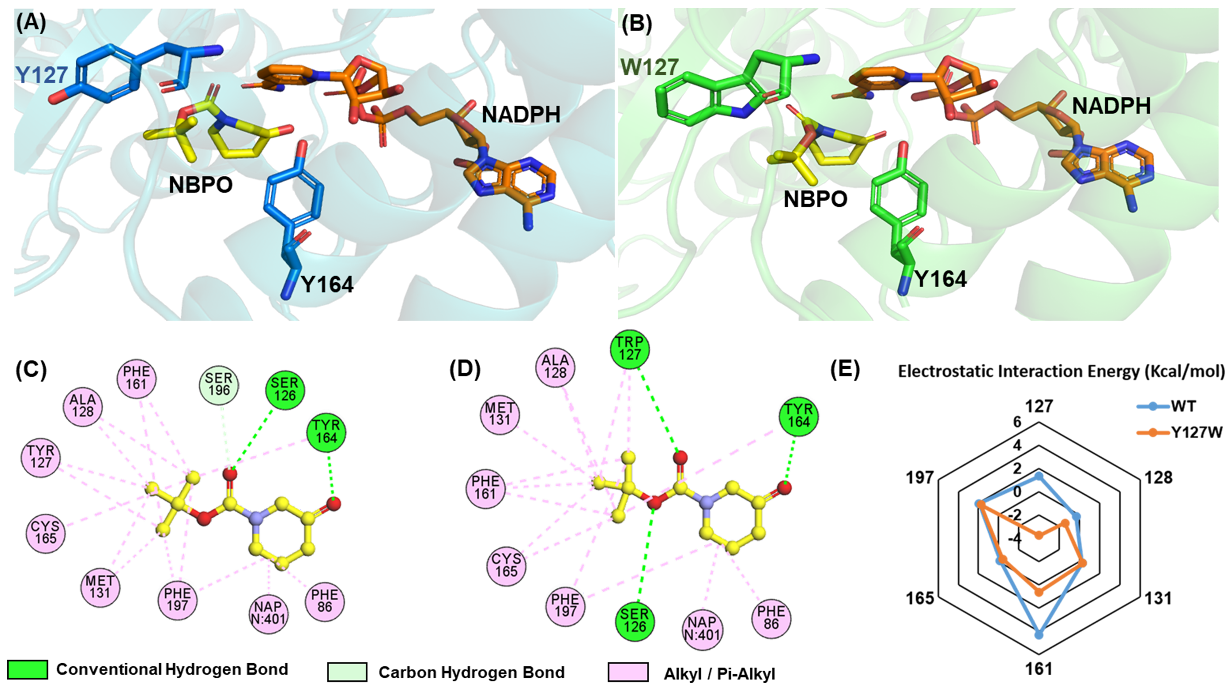
图一. 醇脱氢酶KpADH及其突变体Y127W与底物NBPO的分子对接及作用力分析

图二. 醇脱氢酶KpADH突变体合成依鲁替尼手性醇中间体
倪晔教授和博士后周婕妤为该论文的共同通讯作者,2017级硕士研究生吴彦霏为第一作者。上述研究工作得到了国家重点研发计划项目(2018YFA0901700)、国家自然科学基金 (21907040、21776112和22077054)、中国博士后科学基金项目(2019M651703)以及国家轻工技术与工程一流学科(LITE2018-07)的资助。
